Lipidi e terpeni
I lipidi costituiscono una classe di molecole organiche singolari, poiché la loro identità è definita sulla base di una proprietà fisica e non per la presenza di un particolare gruppo funzionale.
L’elevato numero di legami σ C-C e di legami C-H rende le molecole lipidiche molto solubili nei comuni solventi organici e insolubili in H2O. Composti strutturalmente molto diversi tra loro sono catalogati come lipidi: ad esempio una prostaglandina, un triacilglicerolo e uno steroide, pur non avendo gruppi funzionali comuni, sono tutti lipidi.
L’elevato numero di legami σ C-C e di legami C-H rende le molecole lipidiche molto solubili nei comuni solventi organici e insolubili in H2O. Composti strutturalmente molto diversi tra loro sono catalogati come lipidi: ad esempio una prostaglandina, un triacilglicerolo e uno steroide, pur non avendo gruppi funzionali comuni, sono tutti lipidi.

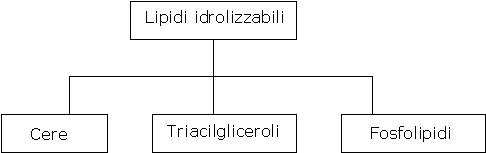
I lipidi possono essere classificati come idrolizzabili e non idrolizzabili.
I lipidi idrolizzabili possono essere trasformati in molecole più piccole per reazioni con H2O, in processi catalizzati da acidi o da basi.
Generalmente a questa categoria appartengono lipidi che contengono il gruppo funzionale degli esteri, e i tre sottogruppi principali sono le cere, i triacilgliceroli (trigliceridi) e i fosfolipidi:
I lipidi non idrolizzabili sono molecole che non possono essere scisse per idrolisi in molecole più piccole. Per questi ultimi si possono individuare 4 sottoclassi:
a) le vitamine liposolubili A, D, E, e K;
b) gli eicosanoidi, una famiglia di molecole biologicamente attive che contengono 20 atomi di carbonio, tutte derivanti dall’acido arachidonico;
c) i terpeni, costituiti da unità di 5 atomi di carbonio, chiamate unità isopreniche. Molti oli essenziali sono terpeni, come ad esempio il mentolo;
d) gli steroidi, un gruppo di lipidi tetraciclici, molti dei quali sono biologicamente attivi, come il colesterolo, gli ormoni sessuali, e gli steroidi adrenocorticali come il cortisone, il cortisolo e l’aldosterone.

Le cere sono lipidi idrolizzabili molto semplici, sono esteri formati da un acido carbossilico ed un alcool ad alto peso molecolare.
Ad esempio il bianco di balena è in gran parte costituito da: CH3(CH2)14COO(CH2)15CH3. Le cere sono molto diffuse in natura ed hanno un ruolo protettivo sia nel regno vegetale sia nel regno animale.
Ad esempio il bianco di balena è in gran parte costituito da: CH3(CH2)14COO(CH2)15CH3. Le cere sono molto diffuse in natura ed hanno un ruolo protettivo sia nel regno vegetale sia nel regno animale.
I triacilgliceroli (definiti anche triglicerdi) costituiscono la classe di lipidi più abbondanti. Essi sono triesteri che per idrolisi forniscono una molecola di glicerina (o glicerolo: 1,2,3-triidrossipropano) e tre molecole di acidi grassi, che contengono dai 12 ai 20 atomi di carbonio.

I trigliceridi semplici contengono acidi grassi con lo stesso gruppo R, mentre i trigliceridi misti (o complessi) contengono due o tre diversi acidi grassi.
Gli acidi grassi ottenuti hanno sempre un numero pari di atomi di carbonio, allineati in lunghe catene lineari, ma che possono essere sature o insature. Quando sono presenti insaturazioni i doppi legami hanno generalmente configurazione cis.
In generale i grassi hanno punti di fusione più alti ed infatti sono solidi a temperatura ambiente. Gli oli hanno punti di fusione più bassi e sono liquidi a temperatura ambiente.
In generale i grassi hanno punti di fusione più alti ed infatti sono solidi a temperatura ambiente. Gli oli hanno punti di fusione più bassi e sono liquidi a temperatura ambiente.
Il punto di fusione di un acido grasso dipende dal grado di insaturazioni. All’aumentare del numero di doppi legami il punto di fusione diminuisce. In assenza di doppi legami le tre lunghe catene laterali di un lipide saturo giacciono parallelamente le une alle altre e la molecola si impacca con una certa efficienza nel reticolo cristallino, effetto che porta ad un più alto punto di fusione.
Basta un solo doppio legame Z per produrre un ripiegamento della catena laterale, rendendo difficoltoso l’impacchettamento nello stato solido e di conseguenza si ha un punto di fusione più basso.
Basta un solo doppio legame Z per produrre un ripiegamento della catena laterale, rendendo difficoltoso l’impacchettamento nello stato solido e di conseguenza si ha un punto di fusione più basso.
Ad esempio:

I grassi solidi hanno una percentuale relativamente alto di acidi grassi saturi e sono generalmente di origine animale. Gli oli liquidi invece, hanno una percentuale più alta di acidi grassi insaturi e di solito sono di origine vegetale o marina.
Ad esempio sono molto ricchi di triacilgliceroli polinsaturi l’olio di fegato di merluzzo e di aringa, che hanno punti di fusione particolarmente bassi, rimanendo liquidi anche in acque gelide.
Come tutti gli esteri, i trigliceridi possono essere idrolizzati in presenza di acidi basi o basi, ma nell’ambiente biologico in cui vengono prodotti e metabolizzati sono idrolizzati da enzimi chiamati lipasi.
Ad esempio sono molto ricchi di triacilgliceroli polinsaturi l’olio di fegato di merluzzo e di aringa, che hanno punti di fusione particolarmente bassi, rimanendo liquidi anche in acque gelide.
Come tutti gli esteri, i trigliceridi possono essere idrolizzati in presenza di acidi basi o basi, ma nell’ambiente biologico in cui vengono prodotti e metabolizzati sono idrolizzati da enzimi chiamati lipasi.
I doppi legami di acidi grassi polinsaturi possono essere idrogenati con H2 in presenza di catalizzatori, convertendo così un olio liquido in un grasso solido. Così si preparano margarine da oli vegetali.
La presenza di doppi legami rende gli acidi grassi polinsaturi soggetti all’ossidazione da parte dell’ossigeno molecolare, tramite un meccanismo radicalico. L’ossidazione produce l’irrancidimento di un olio con rilascio di aldeidi dall’odore sgradevole.
I Fosfolipidi
sono lipidi idrolizzabili che contengono un atomo di fosforo, e sono divisi in due gruppi: i fosfoacilgliceroli, in cui un ossidrile primario della glicerina è esterificato dall’acido fosforico (che a sua volta esterifica anche un altro alcool a basso peso molecolare) e le sfingomieline, derivanti sempre dalla glicerina, contenenti l’estere fosforico, ma anche una funzionalità ammidica.
Entrambe sono i costituenti principali delle membrane cellulari. A differenza dei triacilgliceroli, i fosfolipidi hanno nella loro struttura una testa polare, con gruppi ionizzati e due code apolari. Nelle membrane cellulari un fosfolipide si dispone con la parte polare all’esterno, a contatto con l’H2O, mentre le catene apolari sono rivolte verso l’interno.
Un’altra molecola di fosfolipide si dispone in maniera esattamente opposta, con la coda polare rivolta all’interno a contatto con l’H2O contenuta nella cellula. Questa disposizione realizza il doppio strato lipidico, di cui sono composte tutte le membrane cellulari.
Il rivestimento che circonda e isola le cellule nervose, la guaina mielinica, è particolarmente ricco di sfingomieline. Il suo deterioramento causa rilevanti danni neurologici.
sono lipidi idrolizzabili che contengono un atomo di fosforo, e sono divisi in due gruppi: i fosfoacilgliceroli, in cui un ossidrile primario della glicerina è esterificato dall’acido fosforico (che a sua volta esterifica anche un altro alcool a basso peso molecolare) e le sfingomieline, derivanti sempre dalla glicerina, contenenti l’estere fosforico, ma anche una funzionalità ammidica.
Entrambe sono i costituenti principali delle membrane cellulari. A differenza dei triacilgliceroli, i fosfolipidi hanno nella loro struttura una testa polare, con gruppi ionizzati e due code apolari. Nelle membrane cellulari un fosfolipide si dispone con la parte polare all’esterno, a contatto con l’H2O, mentre le catene apolari sono rivolte verso l’interno.
Un’altra molecola di fosfolipide si dispone in maniera esattamente opposta, con la coda polare rivolta all’interno a contatto con l’H2O contenuta nella cellula. Questa disposizione realizza il doppio strato lipidico, di cui sono composte tutte le membrane cellulari.
Il rivestimento che circonda e isola le cellule nervose, la guaina mielinica, è particolarmente ricco di sfingomieline. Il suo deterioramento causa rilevanti danni neurologici.

Le vitamine sono composti organici necessari in piccole quantità per il normale metabolismo e vanno assunte con la dieta. Esse vengono classificate come idrosolubili e liposolubili. Le vitamine liposolubili son lipidi.
La Vitamina A (retinolo) si trova nell’olio di fegato di merluzzo e viene sintetizzata dal beta-carotene, il pigmento arancione delle carote. Nel corpo umano la vitamina A è convertito nell’ aldeide 11-cis-retinale, una molecola fotosensibile, responsabile nella visione dei vertebrati.
La vitamina D3 è presente in molti alimenti ma è prevalentemente assunta attraverso il latte intero. Essa aiuta a regolare il metabolismo del calcio e del fosforo. La sua carenza causa rachitismo e favorisce lo sviluppo della osteoporosi.
La vitamina E svolge una azione prevalentemente antiossidante e quindi protegge dall’ossidazione le catene laterali insature degli acidi grassi. Una carenza di questa vitamina causa svariati problemi neurologici.
La vitamina E svolge una azione prevalentemente antiossidante e quindi protegge dall’ossidazione le catene laterali insature degli acidi grassi. Una carenza di questa vitamina causa svariati problemi neurologici.
Infine la vitamina K regola la sintesi di diversi fattori proteici necessari per la coagulazione del sangue. Una sua carenza determina emorragie eccessive, dovute a una scarsa tendenza del sangue a coagularsi.

Terpeni
La distillazione in corrente di vapore di numerosi vegetali fornisce una miscela di liquidi profumati, che prendono il nome di oli essenziali. Essi consistono in larga misura in molecole piccole dette terpeni, di solito formate solo da carbonio ed idrogeno, ma spesso contenenti anche ossigeno.
Molte di essi sono quindi idrocarburi, possono avere diversi doppi legami carbonio-carbonio e presentarsi in strutture contenenti uno o più cicli. Quando è presente l’ossigeno ci possiamo trovare di fronte ad alcoli, eteri, aldeidi e chetoni o acidi carbossilici.
La loro classificazione dunque non è per classi chimiche, ma è basata sul numero complessivo di atomi di carbonio contenuti nella loro struttura. In tutti i terpeni si trova una formale correlazione strutturale con una unità di 5 atomi di carbonio, chiamata isoprene (2-metil-1,3-butadiene).
Le varie strutture sono multiple di questa unità base: ad esempio:
Molte di essi sono quindi idrocarburi, possono avere diversi doppi legami carbonio-carbonio e presentarsi in strutture contenenti uno o più cicli. Quando è presente l’ossigeno ci possiamo trovare di fronte ad alcoli, eteri, aldeidi e chetoni o acidi carbossilici.
La loro classificazione dunque non è per classi chimiche, ma è basata sul numero complessivo di atomi di carbonio contenuti nella loro struttura. In tutti i terpeni si trova una formale correlazione strutturale con una unità di 5 atomi di carbonio, chiamata isoprene (2-metil-1,3-butadiene).
Le varie strutture sono multiple di questa unità base: ad esempio:

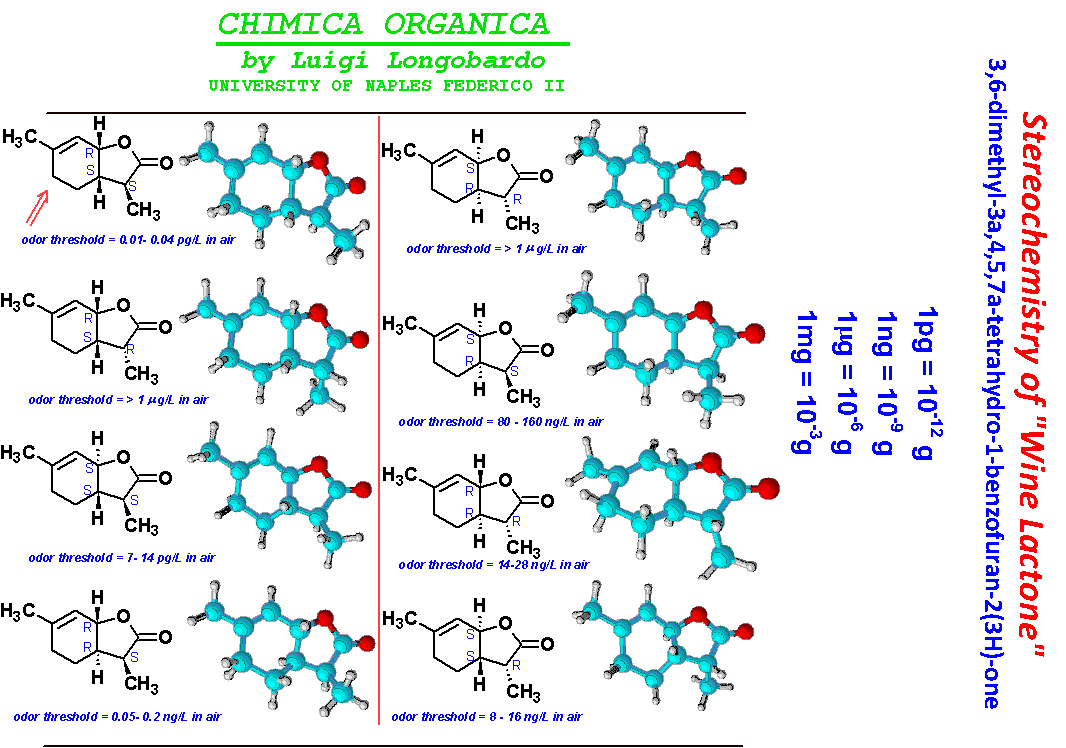
"Wine Lactone"
Un interessante esempio che lega la stereochimica nella chimica dei terpeni alla enologia è riportato da Guth, H. in J. Agric. Food Chem. (1997), volume 45, pg. 3022 che è descritto anche in Tetrahedron: Asymmetry (2003) volume 14, pg. 1–42.
In questo lavoro sono state valutate le proprietà odorose di numerosi vini bianchi, ed è stato mostrato che è presente un aroma naturale molto potente, un lattone biciclico. A questa molecola, presente in tracce nel vino, sono state attribuite note dolciastre e di cocco, è stata chiamata appunto “wine lactone”.

Questo lattone deriva dal limonene e avendo 3 carboni chirali sono possibili 8 stereoisomeri. Per poter stabilire a quale stereoisomero corrisponde quello presente nei vini bianchi, i chimici hanno preparato in laboratorio tutte le molecole.
4 stereoisomeri sono stati preparati dal R-(+)-limonene (dalle arance) e gli altri 4 partendo dal S-(-)-limonene (dal limone). Disponendo di tutti gli stereoisomeri, è stato così possibile determinare anche le soglie di percezione di ognuno di essi.
Il lattone 1 ha mostrato una soglia di percezione al di sotto di 0.00001 ng /litro, mentre lo stereoisomero 4, ma anche 8 (che è l’enantiomero di 1), sono risultati molto al di sopra di 1000 ng/litro. Gli stereoisomeri più potenti, con le soglie di percezione più basse, sono risultati i lattoni 1, 2 e 5.
Tutti e tre stereoisomeri hanno configurazione S al carbonio che porta il gruppo metile. Il “lattone del vino” naturale è stato trovato identico allo stereoisomero 1.
4 stereoisomeri sono stati preparati dal R-(+)-limonene (dalle arance) e gli altri 4 partendo dal S-(-)-limonene (dal limone). Disponendo di tutti gli stereoisomeri, è stato così possibile determinare anche le soglie di percezione di ognuno di essi.
Il lattone 1 ha mostrato una soglia di percezione al di sotto di 0.00001 ng /litro, mentre lo stereoisomero 4, ma anche 8 (che è l’enantiomero di 1), sono risultati molto al di sopra di 1000 ng/litro. Gli stereoisomeri più potenti, con le soglie di percezione più basse, sono risultati i lattoni 1, 2 e 5.
Tutti e tre stereoisomeri hanno configurazione S al carbonio che porta il gruppo metile. Il “lattone del vino” naturale è stato trovato identico allo stereoisomero 1.

vedi anche http://www.leffingwell.com/chirality/winelactone.htm
Steroidi
Gli steroidi costituiscono una vasta classe di molecole, che giocano un ruolo biologico essenziale, ed hanno in comune una struttura tetraciclica.
Essi si trovano in tutti gli organismi, sia animali sia vegetali, ma quelli più importanti sono di origine animale. Lo steroide più diffuso è un alcol cristallino, il colesterolo, C27H46O.
Nella sua struttura sono presenti ben 8 atomi di carbonio asimmetrici, e dunque sono possibili complessivamente 256 stereoisomeri. Ma solo uno è presente in natura.
La trasformazione biochimica del colesterolo conduce a numerose altre molecole di tipo steroideo, essenziali per il metabolismo e la riproduzione nei mammiferi, come gli acidi biliari, la vitamina D3, gli ormoni corticali come il cortisone, che ha una potente azione antiinfiammatoria, e gli ormoni sessuali.
Di seguito sono anche mostrati alcuni ormoni sintetici utilizzati nella prevenzione di gravidanze indesiderate.
Nella sua struttura sono presenti ben 8 atomi di carbonio asimmetrici, e dunque sono possibili complessivamente 256 stereoisomeri. Ma solo uno è presente in natura.
La trasformazione biochimica del colesterolo conduce a numerose altre molecole di tipo steroideo, essenziali per il metabolismo e la riproduzione nei mammiferi, come gli acidi biliari, la vitamina D3, gli ormoni corticali come il cortisone, che ha una potente azione antiinfiammatoria, e gli ormoni sessuali.
Di seguito sono anche mostrati alcuni ormoni sintetici utilizzati nella prevenzione di gravidanze indesiderate.