ESTERI E LATTONI
Nella struttura degli esteri sono chiaramente visibili due particolari raggruppamenti atomici: il gruppo acile, derivante da un acido carbossilico ed un gruppo alcossido, derivante da un alcol.
La loro formazione può quindi essere ottenuta promuovendo una reazione di condensazione tra un acido carbossilico ed un alcol, un processo generalmente catalizzato da una piccola quantità di acido forte, dove si produce anche un equivalente di H2O:
La loro formazione può quindi essere ottenuta promuovendo una reazione di condensazione tra un acido carbossilico ed un alcol, un processo generalmente catalizzato da una piccola quantità di acido forte, dove si produce anche un equivalente di H2O:

E’ un processo di equilibrio che può essere indirizzato verso la formazione dei prodotti aumentando la concentrazione di uno dei reagenti (di solito il meno pregiato) oppure rimovendo uno dei prodotti di reazione, di solito l’H2O se l’estere ha un punto di ebollizione più alto.
Una analogia dalla chimica inorganica che può aiutare a comprendere il principio dell’equilibrio mobile, considerando il caso dell’idrossido ferrico, un idrossido particolarmente insolubile:
Una analogia dalla chimica inorganica che può aiutare a comprendere il principio dell’equilibrio mobile, considerando il caso dell’idrossido ferrico, un idrossido particolarmente insolubile:
Se si vuole aumentare la concentrazione di Fe3+ in soluzione, basta aggiungere un acido forte, il quale, sottraendo OH- all’equilibrio, determina uno spostamento verso destra dell’equilibrio stesso, favorendo lo scioglimento dell’idrossido ferrico.
Sono possibili anche processi di esterificazione intramolecolari, nei quali sia la funzionalità carbossilica che quella alcolica sono presenti sulla stessa molecola. In questo modo a partire da idrossiacidi si ottengono esteri ciclici definiti lattoni.
Cosi se si parte dall’acido 3-idrossibutirrico si ottiene il corrispondente beta-lattone.
Cosi se si parte dall’acido 3-idrossibutirrico si ottiene il corrispondente beta-lattone.
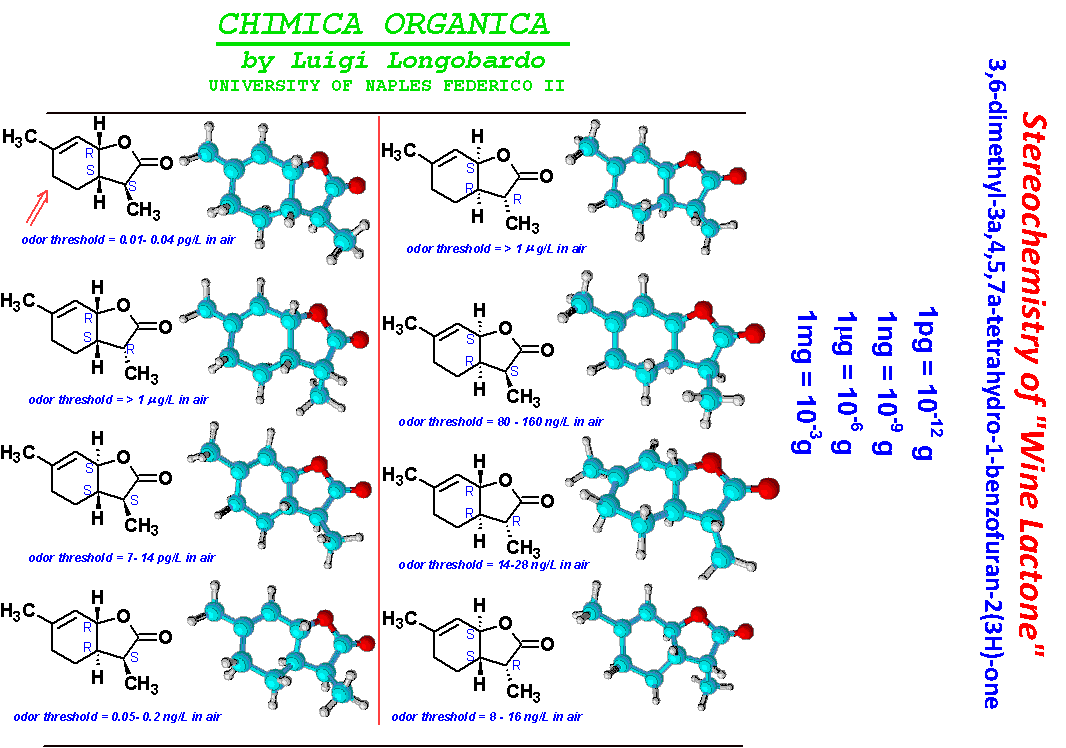
Analogamente partendo da 4-idrossiacidi e 5-idrossiacidi si ottengono i corrispondenti gamma- e delta-lattoni rispettivamente. I beta-lattoni sono poco stabili e quindi poco diffusi in natura, mentre i gamma- e i delta-lattoni variamente sostituiti sono largamente diffusi in natura e costituiscono una delle principali componenti odorose di molti frutti e vegetali.

Come già osservato, le ammine mostrano caratteristiche basiche poiché dispongono di un doppietto di elettroni sull’atomo di azoto, capace di formare un legame con un protone. Compariamo le proprietà acido-base di acido acetico, etilammina e acetammide:

Si osserva che l’acido acetico sciolto in H2O produce una soluzione acida mentre la etilammina produce una soluzione basica. Di contro aggiungendo acetammide all’H2O non si osserva alcuna variazione di pH. Dobbiamo quindi concludere che il doppietto di elettroni sull’azoto non è disponibile. Perché?
Per l’acetammide si può scrivere una struttura limite di risonanza a separazione di carica, che di fatto impegna il doppietto non condiviso sull’azoto. Questa situazione si può realizzare solo se l’atomo di azoto è ibridato sp2 ed il doppietto è quindi presente in un orbitale p. Questa è la condizione necessaria per la formazione di un doppio legame

Con l’ibridazione sp2 anche dell’atomo di azoto si costringono tutti gli atomi legati al gruppo ammidico a disporsi sullo stesso piano. In seguito, studiando le proteine, si potrà osservare come questa condizione influenza la loro struttura tridimensionale.
Al fine di chiarire meglio il concetto di risonanza, consideriamo uno ione molto comune: lo ione carbonato: CO32-

Questa struttura è stata considerata corretta fino a quando non si è avuto a disposizione un struttura ottenuta con i Raggi X su cristalli di carbonato di calcio.
Si è osservato che le distanze carbonio-ossigeno sono tutte uguali. Di conseguenza la struttura reale si può descrivere come ibrido di risonanza di tre strutture equivalenti, isoenergetiche. Ogni atomo di ossigeno è legato al carbonio centrale da un legame che è un ibrido tra uno doppio (1/3) e uno singolo (2/3) e su ognuno di essi è collocata 2/3 di carica negativa. I tre atomi di ossigeno sono cosi identici:
Si è osservato che le distanze carbonio-ossigeno sono tutte uguali. Di conseguenza la struttura reale si può descrivere come ibrido di risonanza di tre strutture equivalenti, isoenergetiche. Ogni atomo di ossigeno è legato al carbonio centrale da un legame che è un ibrido tra uno doppio (1/3) e uno singolo (2/3) e su ognuno di essi è collocata 2/3 di carica negativa. I tre atomi di ossigeno sono cosi identici:

Spesso in chimica organica osserviamo fenomeni che non sono descrivibili unicamente invocando le strutture limite di risonanza ma occorre considerare anche aspetti più propriamente elettronici.
Consideriamo a esempio la seguente scala di acidità osservata per gli acidi acetici cloro-sostituiti:

Le strutture di risonanza degli ioni carbossilato in questo caso non riescono a spiegare da sole differenza di acidità così marcate. Poiché il cloro è più elettronegativo del carbonio, il legame C-Cl è polarizzato con un delta- sull’atomo di cloro e un delta+ sull’atomo di carbonio.
Gli elettroni del carbossilato sono attratti verso l’atomo di cloro e questo effetto è tanto più marcato quanto maggiore è il numero di atomi di cloro. Si realizza così una stabilizzazione extra degli ioni cloro-acetato rispetto allo ione acetato, producendo l’aumento di acidità osservato.