17 nov 2010
2 set 2010
Esami
Il prossimo appello è fissato per mercoledì 22 settembre 2010 alle ore 9.
Occorre prenotarsi via ESIS entro il 16 settembre
Occorre prenotarsi via ESIS entro il 16 settembre
29 giu 2010
Esame scritto del 28 Giugno 2010
Università degli Studi di Napoli Federico II
Scritto di Fondamenti Chimica Organica
28 Giugno 2010
|
1. Scrivere le strutture di Lewis delle molecole di seguito indicate, contenenti tutte un solo atomo di carbonio. Indicarne la sua ibridazione e la geometria molecolare osservata: a) anidride carbonica; b) metanolo; c) metanale; d) acido metanoico; e) metilammina; f) metanammide.
2. Scrivere la struttura delle molecole di seguito elencate, indicando per ognuna la classe di appartenenza e il numero di stereoisomeri possibili:
a) 2,3-butandiolo; b) 3,4-dicloro-4-(3,5-diidrossifenil)butan-2-one; c) acido 3-etil-5-idrossi-2-octenoico; d) 2-amino-3-idrossibutanamide; e) 2,3,4-triidrossibutanale; f) acido 2-amino-3-idrossibutandioico.
a) 2,3-butandiolo; b) 3,4-dicloro-4-(3,5-diidrossifenil)butan-2-one; c) acido 3-etil-5-idrossi-2-octenoico; d) 2-amino-3-idrossibutanamide; e) 2,3,4-triidrossibutanale; f) acido 2-amino-3-idrossibutandioico.
3. Il punto isoelettrico della glicina è 6. In che forma la troviamo a questo pH?
a) Qual è la forma prevalente allo stesso pH dell'acido acetico, della etilammina, dell'acetammide e dell’etanolo? b) Spiegare brevemente perché un'ammina è basica mentre una ammide è neutra; c) C'è una relazione tra la risposta data in b) e l'esistenza delle proteine?
a) Qual è la forma prevalente allo stesso pH dell'acido acetico, della etilammina, dell'acetammide e dell’etanolo? b) Spiegare brevemente perché un'ammina è basica mentre una ammide è neutra; c) C'è una relazione tra la risposta data in b) e l'esistenza delle proteine?
4. Dare una spiegazione ai seguenti fatti sperimentali: a) Il benzene da reazione di sostituzione elettrofila e non di addizione; b) Posto in un solvente polare il 3-clorociclopropene si dissocia in un carbocatione e lo ione cloruro; c) La piridina e il pirrolo sono entrambe aromatiche ma solo la piridina è basica; d) l’1,3-ciclopentadiene ha un pKa di 15.
5. Proporre, con un esempio, la struttura delle molecole di seguito classificate:
a) un L-deossialdoesoso; b) un D-chetopentoso; c) un L-a-amminoacido a pH 2;
d) un lipide idrolizzabile; e) una base pirimidinica presente nel RNA;
f) un generico dipeptide formato da D-a-amminoacidi.
a) un L-deossialdoesoso; b) un D-chetopentoso; c) un L-a-amminoacido a pH 2;
d) un lipide idrolizzabile; e) una base pirimidinica presente nel RNA;
f) un generico dipeptide formato da D-a-amminoacidi.
22 giu 2010
Esame scritto del 7 giugno 2010
1. Alla formula molecolare C4H8O2 corrispondono molecole appartenenti a varie classi. Suggerire il maggior numero di strutture possibili, assegnando ad ognuna la classe di appartenenza e il nome IUPAC.
2. Scrivere la struttura delle molecole di seguito elencate, indicando per ognuna la classe di appartenenza e il numero di stereoisomeri possibili: a) 2,3-diclorobutano; b) 3-(3-bromofenil)-3-idrossipropanale; c) acido 3-metil-2-esenoico; d) 3,4-diidrossipentanammide e) 2,3-dimetil-g-butirrolattone; f) 4,5-difeniloctan-3,6-dione.
3. Scrivere le strutture dei seguenti polifenoli, presenti prevalentemente nei vini rossi:
a) acido 2,4-diidrossibenzoico; b) acido 3,4,5-triidrossibenzoico; c) acido 3-idrossi-5-metossibenzoico; d) acido (2E)-3-(4-idrossifenil)prop-2-enoico; e) acido (2E)-3-(3,4-diidrossifenil)prop-2-enoico; f) acido (2E)-3-(4-idrossi-3-metossifenil)prop-2-enoico.
a) acido 2,4-diidrossibenzoico; b) acido 3,4,5-triidrossibenzoico; c) acido 3-idrossi-5-metossibenzoico; d) acido (2E)-3-(4-idrossifenil)prop-2-enoico; e) acido (2E)-3-(3,4-diidrossifenil)prop-2-enoico; f) acido (2E)-3-(4-idrossi-3-metossifenil)prop-2-enoico.
4. Dare una spiegazione delle seguenti osservazioni sperimentali: a) l’acido acetico ha un pKa = 5, mentre l’etanolo ha un pKa = 16; b) l’acido acetico ha un pKa = 5 mentre l’acido tricloroacetico ha un pKa = 1; c) il fenolo ha un pKa = 10 mentre il cicloesanolo ha un pKa = 16 ; d) perchè la etilammina è una sostanza basica con un pKb = 4, mentre l’acetammide è una sostanza neutra?
5. Proporre, con un esempio, la struttura delle molecole di seguito classificate:
a) un L-deossi aldopentososo; b) un D-chetoesoso; c) un D-a-aminoacido a pH 10; d) un lipide idrolizzabile; e) una base pirimidinica presente nel DNA; f) quanti sono i tripeptidi possibili utilizzando 3 a-amminoacidi racemi?
a) un L-deossi aldopentososo; b) un D-chetoesoso; c) un D-a-aminoacido a pH 10; d) un lipide idrolizzabile; e) una base pirimidinica presente nel DNA; f) quanti sono i tripeptidi possibili utilizzando 3 a-amminoacidi racemi?
Tempo a disposizione 2h. Si considera superata la prova con almeno 3 esercizi risolti
3 mag 2010
Purine + Pirimidine ed acidi nucleici
Nucleosidi, nucleotidi ed acidi nucleici
Dettagli possono essere trovati al link:
26 apr 2010
Lipidi
Lipidi e terpeni
Le sostanze grasse. Classificazione in base alle proprietà fisiche e non in base alla presenza di particolari gruppi funzionali. Lipidi idrolizzabili: cere, trigliceridi e fosfolipidi. Lipidi non idrolizzabili: vitamine liposolubili, eicosanoidi, terpeni e steroidi. Alimentazione e Salute. La dieta mediterranea e quella anglossasone!
Per ulteriori dettagli vedi:
21 apr 2010
Amminoacidi, peptidi e proteine
Amminoacidi, peptidi e proteine
Cenni sulla formazione prebiotica degli amminoacidi. Necessità di condizioni di asimmetria (chiralità) nella loro formazione. Il mondo L. Sterochimica degli amminoacidi. Proprietà acido-base. Il legame ammidico. Peptidi, proteine. Evoluzione chimica ed evoluzione biologica. Mondi reali e mondi possibili.
Per ulteriori dettagli vedi:
Carboidrati II
Carboidrati II
Formazione di emiacetali e acetali. Rappresentazione con le formule di Haworth e a sedia dei carboidrati. O-Glicosidi. Mutarotazione. Disaccaridi: Saccarosio, Maltosio, Lattosio e Cellobiosio. Polisaccaridi: Cellulosa e amido. La differenza tra uomini e mucche nel reperire il D-glucosio.
I colori del mondo naturale: Antocianine e loro glicoconiugati.

I colori del mondo naturale: Antocianine e loro glicoconiugati.

Per ulteriori dettagli vedi:
http://fco0809.blogspot.com/2009/05/lezione-del-28-aprile-2009.html
Separazioni di miscele di sostanze organiche
Separazioni di miscele di sostanze organiche sfruttando le loro proprietà acido-base. Cenni di cromatografia.
per ulteriori dettagli vedi:
http://fco0809.blogspot.com/2009/04/lezione-del-21-aprile-2009.html
per ulteriori dettagli vedi:
http://fco0809.blogspot.com/2009/04/lezione-del-21-aprile-2009.html
14 apr 2010
Carboidrati I
Carboidrati I
Il ciclo del carbonio. Cenni di fotosintesi clorofilliana. idrati di Carbonio, Cn(H2O)n. Il gruppo carbonilico. Fattori governanti la reattività. Reazioni tra composti carbonolici ed alcoli: formazione di emiacetali.
Per ulteriori dettagli vedi: Acetali e Carboidrati I
http://fco0809.blogspot.com/2009/04/lezione-del-22-aprile-2009.html
http://fco0809.blogspot.com/2009/04/lezione-del-22-aprile-2009.html
31 mar 2010
Acidi, Esteri e Lattoni
Acidi, Esteri e Lattoni.
Derivati degli acidi carbossilici
I principali acidi mono-, bi-, e tricarbossilici presenti nei vini:
Lattoni:
Quando la funzione alcolica è essa stessa presente nella struttura dell'acido carbossilico si forma un estere ciclico, che prende il nome di lattone:
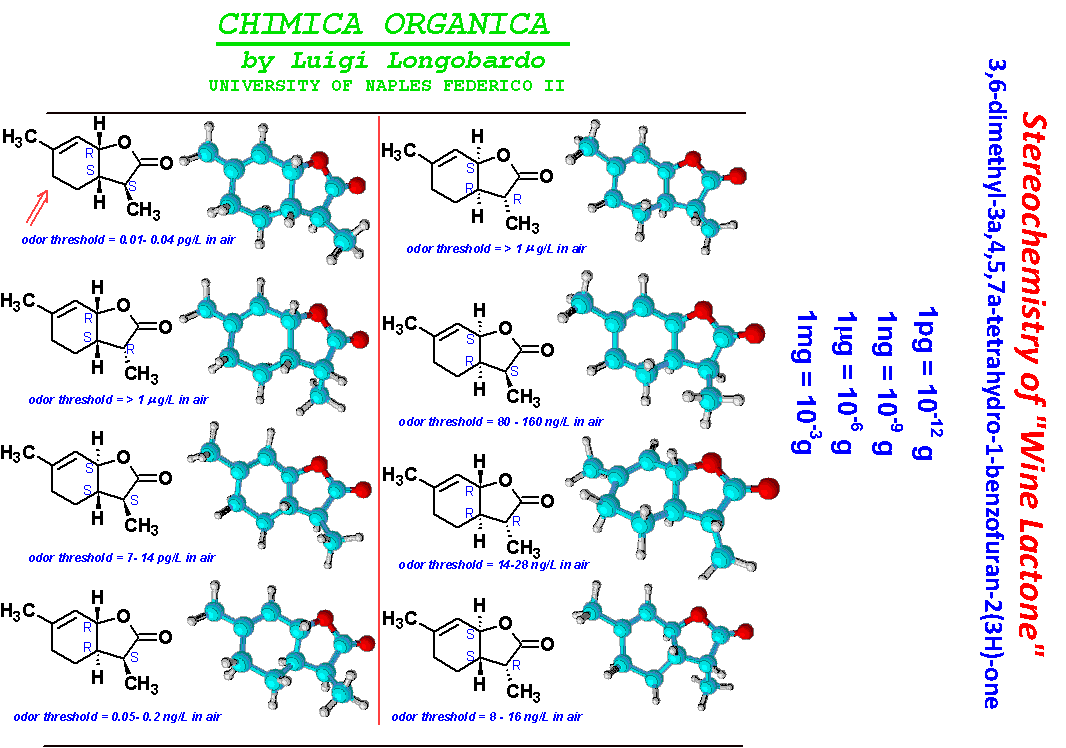
Per una discussione generale sul "wine Lacton" vedi:
http://fco0809.blogspot.com/2009/05/lezione-del-6-maggio-2009.htmlDerivati degli acidi carbossilici:
Si definiscono derivati degli acidi carbossilici tutte quelle sostanze che per idrolisi (reazioni con H2O, catalizzate da acidi o basi) forniscono i corrispondenti acidi carbossilici. Tra essi, gli alogenuri acilici e le anidridi sono troppo reattive e pertanto non si trovano in natura. A differenza degli alogenuri alchilici, dove l'atomo di alogeno è legato ad un carbonio sp3, negli alogenuri acilici l'alogeno è legato direttamente al carbonio carbonilico ibridato sp2:
Aromaticità e composti aromatici
Aromaticità e composti aromatici
Per una discussione generale sulla aromaticità vedi nell'archivio aprile 2009
25 mar 2010
Enantiomeri e diastereoisomeri
Una datazione al carbonio 14 per le annate del vino
Dal sito de le Scienze
HTTP://LESCIENZE.ESPRESSO.REPUBBLICA.IT/ARTICOLO/ARTICOLO/1342550
HTTP://LESCIENZE.ESPRESSO.REPUBBLICA.IT/ARTICOLO/ARTICOLO/1342550
CHIMICA
Convegno dell’American Chemical Society
Una datazione al carbonio 14 per le annate del vino
Il metodo si basa sulla misurazione degli isotopi del carbonio contenuto nel vino: l'abbondanza relativa è stata alterata dagli esperimenti nucleari in atmosfera ammessi fino al 1963

24 mar 2010
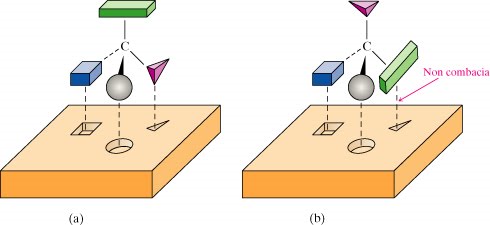
Introduzione alla stereochimica
Introduzione alla Stereochimica
Dalla isomeria strutturale alla stereoisomeria. L'acido tartarico e la nascita della stereochimica. Il lavoro di L. Pasteur. Oggetti chirali e oggetti non chirali. Gli oggetti chirali hanno una immagine speculare che non è sovrapponibile all'oggetto originale.
L'atomo di carbonio asimmetrico. Elementi di simmetria molecolare. Assi e piani di simmetria. Gli stereoisomeri dell'acido tartarico. Enantiomeri e diastereoisomeri. Le mesoforme.
Come si distinguono 2 enantiomeri? La luce polarizzata. Polarizzatore. Misure di potere ottico rotatorio. Interazioni degli enantiomeri con altre sostanze chirali. Primi esempi di relazione struttura-proprietà.
La soluzione al grande enigma della Chimica Organica
I recettori biologici sono chirali. Interazione di due enantiomeri con un recettore biologico. Le proprietà odorose del limonene. Arancio e limone. Stereochimica assoluta. Attribuzione della configurazione assoluta a un atomo di carbonio asimmetrico.
Descrittori stereochimici R e S.
Descrittori stereochimici R e S.
Vedi anche Stereochimica I e Stereochimica II
http://fco0809.blogspot.com/2009/04/lezione-del-31-marzo-2009.html
http://fco0809.blogspot.com/2009/04/lezione-del-1-aprile-2009.html
17 mar 2010
Nomenclatura
Nomenclatura
La necessità di attribuire un nome alle molecole. Utilizzo del software ACDlab.
Primi esempi: geometria E-Z negli alcheni
Ulteriori esempi:
Acidità e basicità delle molecole organiche. Una introduzione. Comparazione tra l'acidità dell'acido acetico e dell'alcol etilico. Il ruolo della termodinamica e della cinetica nei processi chimici. Le reazioni acido-base.
Introduzione alla risonanza.
Composti ciclici. Ciclopropano, ciclobutano, ciclopentano, cicloesano.
Isomeria cis-trans nei 1,2-dimetilciclopropani
Ibridazione dell'atomo di carbonio e gruppi funzionali
Ibridazione
Configurazione elettronica del carbonio. La struttura e la forma del metano. Indistinguibilità dei legami C-H nel metano. Formazione di orbitali ibridi a partire dagli orbitali atomici. Ibridazione sp3. Geometria tetraedrica. Alcani. Ibridazione sp2. Formazione dei legami sigma e pi-greca. Geometria planare dell'etilene. Alcheni superiori. Ibridazione sp. Alchini. Gruppi funzionali. Alcoli, eteri, aldeidi, chetoni, acidi carbossilici, ammine, ammidi. Introduzione alla nomenclatura delle molecole organiche.
vedi anche http://fco0809.blogspot.com/2009/03/lezione-del-17-marzo-2009.html
10 mar 2010
Molecole
Molecole
Molecole organiche ed inorganiche. I principali atomi che si incontrano nella Chimica Organica. Idrogeno, ossigeno, azoto e carbonio. La formazione dei legami chimici. La molecola di H2. Orbitali atomici e molecolari. Isotopi dell'ossigeno. Ossigeno molecolare. Ammoniaca. Carbonio. Isotopi. Ossido e anidride carbonica. Metano. Idrocarburi. Reazioni di combustione con l'ossigeno. Formule molecolari e formule di struttura. Introduzione alla isomeria strutturale. Primi esempi: C2H4O2 e C3H6O2.
Introduzione alla Chimica Organica
Introduzione alla Chimica Organica
Tutte le rappresentazioni molecolari, incluse la discussione sulle proprietà periodiche degli elementi, sono generate usando il software ACD/ChemSketch versione 12.0 Freeware, scaricabile all'indirizzo http://www.acdlabs.com/download/chemsketch/
La tavola periodica. Elementi ed atomi. Il nucleo atomico. Cenni di nucleosintesi. Fusione e fissione atomica. Isotopi. Isotopi dell'uranio. Le proprietà periodiche degli elementi. Potenziale di ionizzazione, affinità elettronica ed elettronegatività. Atomi e molecole. Cenni di meccanica quantistica. Funzione d'onda. Configurazione elettronica. Legami covalenti e legami ionici.
Iscriviti a:
Post (Atom)