AAC – AMINO ACIDS CHEMISTRY DEPARTMENT OF CHEMICAL SCIENCES AT UNINA Dr. Luigi Longobardo • Room 2N19; Lab 2N18ab; • phone +39-081-674115; • Email: luilongo@unina.it; luilongo@gmai.com • orcid • webdocenti • Group website: http://fco0809.blogspot.it/ Research: Asymmetric synthesis Synthetic manipulation of α-amino acids. Sulfur and selenium-containing unnatural amino acids. Chemistry of Hydroxycinnamic Acids.
17 nov 2009
21 ott 2009
30 set 2009
26 lug 2009
1 lug 2009
14 mag 2009
Lipidi e terpeni
Lipidi e terpeni
I lipidi costituiscono una classe di molecole organiche singolari, poiché la loro identità è definita sulla base di una proprietà fisica e non per la presenza di un particolare gruppo funzionale.
L’elevato numero di legami σ C-C e di legami C-H rende le molecole lipidiche molto solubili nei comuni solventi organici e insolubili in H2O. Composti strutturalmente molto diversi tra loro sono catalogati come lipidi: ad esempio una prostaglandina, un triacilglicerolo e uno steroide, pur non avendo gruppi funzionali comuni, sono tutti lipidi.
L’elevato numero di legami σ C-C e di legami C-H rende le molecole lipidiche molto solubili nei comuni solventi organici e insolubili in H2O. Composti strutturalmente molto diversi tra loro sono catalogati come lipidi: ad esempio una prostaglandina, un triacilglicerolo e uno steroide, pur non avendo gruppi funzionali comuni, sono tutti lipidi.

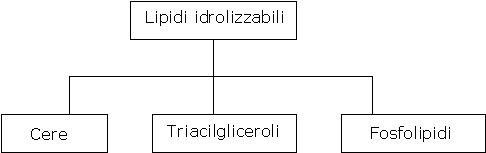
I lipidi possono essere classificati come idrolizzabili e non idrolizzabili.
I lipidi idrolizzabili possono essere trasformati in molecole più piccole per reazioni con H2O, in processi catalizzati da acidi o da basi.
Generalmente a questa categoria appartengono lipidi che contengono il gruppo funzionale degli esteri, e i tre sottogruppi principali sono le cere, i triacilgliceroli (trigliceridi) e i fosfolipidi:
I lipidi non idrolizzabili sono molecole che non possono essere scisse per idrolisi in molecole più piccole. Per questi ultimi si possono individuare 4 sottoclassi:
a) le vitamine liposolubili A, D, E, e K;
b) gli eicosanoidi, una famiglia di molecole biologicamente attive che contengono 20 atomi di carbonio, tutte derivanti dall’acido arachidonico;
c) i terpeni, costituiti da unità di 5 atomi di carbonio, chiamate unità isopreniche. Molti oli essenziali sono terpeni, come ad esempio il mentolo;
d) gli steroidi, un gruppo di lipidi tetraciclici, molti dei quali sono biologicamente attivi, come il colesterolo, gli ormoni sessuali, e gli steroidi adrenocorticali come il cortisone, il cortisolo e l’aldosterone.

Le cere sono lipidi idrolizzabili molto semplici, sono esteri formati da un acido carbossilico ed un alcool ad alto peso molecolare.
Ad esempio il bianco di balena è in gran parte costituito da: CH3(CH2)14COO(CH2)15CH3. Le cere sono molto diffuse in natura ed hanno un ruolo protettivo sia nel regno vegetale sia nel regno animale.
Ad esempio il bianco di balena è in gran parte costituito da: CH3(CH2)14COO(CH2)15CH3. Le cere sono molto diffuse in natura ed hanno un ruolo protettivo sia nel regno vegetale sia nel regno animale.
I triacilgliceroli (definiti anche triglicerdi) costituiscono la classe di lipidi più abbondanti. Essi sono triesteri che per idrolisi forniscono una molecola di glicerina (o glicerolo: 1,2,3-triidrossipropano) e tre molecole di acidi grassi, che contengono dai 12 ai 20 atomi di carbonio.

I trigliceridi semplici contengono acidi grassi con lo stesso gruppo R, mentre i trigliceridi misti (o complessi) contengono due o tre diversi acidi grassi.
Gli acidi grassi ottenuti hanno sempre un numero pari di atomi di carbonio, allineati in lunghe catene lineari, ma che possono essere sature o insature. Quando sono presenti insaturazioni i doppi legami hanno generalmente configurazione cis.
In generale i grassi hanno punti di fusione più alti ed infatti sono solidi a temperatura ambiente. Gli oli hanno punti di fusione più bassi e sono liquidi a temperatura ambiente.
In generale i grassi hanno punti di fusione più alti ed infatti sono solidi a temperatura ambiente. Gli oli hanno punti di fusione più bassi e sono liquidi a temperatura ambiente.
Il punto di fusione di un acido grasso dipende dal grado di insaturazioni. All’aumentare del numero di doppi legami il punto di fusione diminuisce. In assenza di doppi legami le tre lunghe catene laterali di un lipide saturo giacciono parallelamente le une alle altre e la molecola si impacca con una certa efficienza nel reticolo cristallino, effetto che porta ad un più alto punto di fusione.
Basta un solo doppio legame Z per produrre un ripiegamento della catena laterale, rendendo difficoltoso l’impacchettamento nello stato solido e di conseguenza si ha un punto di fusione più basso.
Basta un solo doppio legame Z per produrre un ripiegamento della catena laterale, rendendo difficoltoso l’impacchettamento nello stato solido e di conseguenza si ha un punto di fusione più basso.
Ad esempio:

I grassi solidi hanno una percentuale relativamente alto di acidi grassi saturi e sono generalmente di origine animale. Gli oli liquidi invece, hanno una percentuale più alta di acidi grassi insaturi e di solito sono di origine vegetale o marina.
Ad esempio sono molto ricchi di triacilgliceroli polinsaturi l’olio di fegato di merluzzo e di aringa, che hanno punti di fusione particolarmente bassi, rimanendo liquidi anche in acque gelide.
Come tutti gli esteri, i trigliceridi possono essere idrolizzati in presenza di acidi basi o basi, ma nell’ambiente biologico in cui vengono prodotti e metabolizzati sono idrolizzati da enzimi chiamati lipasi.
Ad esempio sono molto ricchi di triacilgliceroli polinsaturi l’olio di fegato di merluzzo e di aringa, che hanno punti di fusione particolarmente bassi, rimanendo liquidi anche in acque gelide.
Come tutti gli esteri, i trigliceridi possono essere idrolizzati in presenza di acidi basi o basi, ma nell’ambiente biologico in cui vengono prodotti e metabolizzati sono idrolizzati da enzimi chiamati lipasi.
I doppi legami di acidi grassi polinsaturi possono essere idrogenati con H2 in presenza di catalizzatori, convertendo così un olio liquido in un grasso solido. Così si preparano margarine da oli vegetali.
La presenza di doppi legami rende gli acidi grassi polinsaturi soggetti all’ossidazione da parte dell’ossigeno molecolare, tramite un meccanismo radicalico. L’ossidazione produce l’irrancidimento di un olio con rilascio di aldeidi dall’odore sgradevole.
I Fosfolipidi
sono lipidi idrolizzabili che contengono un atomo di fosforo, e sono divisi in due gruppi: i fosfoacilgliceroli, in cui un ossidrile primario della glicerina è esterificato dall’acido fosforico (che a sua volta esterifica anche un altro alcool a basso peso molecolare) e le sfingomieline, derivanti sempre dalla glicerina, contenenti l’estere fosforico, ma anche una funzionalità ammidica.
Entrambe sono i costituenti principali delle membrane cellulari. A differenza dei triacilgliceroli, i fosfolipidi hanno nella loro struttura una testa polare, con gruppi ionizzati e due code apolari. Nelle membrane cellulari un fosfolipide si dispone con la parte polare all’esterno, a contatto con l’H2O, mentre le catene apolari sono rivolte verso l’interno.
Un’altra molecola di fosfolipide si dispone in maniera esattamente opposta, con la coda polare rivolta all’interno a contatto con l’H2O contenuta nella cellula. Questa disposizione realizza il doppio strato lipidico, di cui sono composte tutte le membrane cellulari.
Il rivestimento che circonda e isola le cellule nervose, la guaina mielinica, è particolarmente ricco di sfingomieline. Il suo deterioramento causa rilevanti danni neurologici.
sono lipidi idrolizzabili che contengono un atomo di fosforo, e sono divisi in due gruppi: i fosfoacilgliceroli, in cui un ossidrile primario della glicerina è esterificato dall’acido fosforico (che a sua volta esterifica anche un altro alcool a basso peso molecolare) e le sfingomieline, derivanti sempre dalla glicerina, contenenti l’estere fosforico, ma anche una funzionalità ammidica.
Entrambe sono i costituenti principali delle membrane cellulari. A differenza dei triacilgliceroli, i fosfolipidi hanno nella loro struttura una testa polare, con gruppi ionizzati e due code apolari. Nelle membrane cellulari un fosfolipide si dispone con la parte polare all’esterno, a contatto con l’H2O, mentre le catene apolari sono rivolte verso l’interno.
Un’altra molecola di fosfolipide si dispone in maniera esattamente opposta, con la coda polare rivolta all’interno a contatto con l’H2O contenuta nella cellula. Questa disposizione realizza il doppio strato lipidico, di cui sono composte tutte le membrane cellulari.
Il rivestimento che circonda e isola le cellule nervose, la guaina mielinica, è particolarmente ricco di sfingomieline. Il suo deterioramento causa rilevanti danni neurologici.

Le vitamine sono composti organici necessari in piccole quantità per il normale metabolismo e vanno assunte con la dieta. Esse vengono classificate come idrosolubili e liposolubili. Le vitamine liposolubili son lipidi.
La Vitamina A (retinolo) si trova nell’olio di fegato di merluzzo e viene sintetizzata dal beta-carotene, il pigmento arancione delle carote. Nel corpo umano la vitamina A è convertito nell’ aldeide 11-cis-retinale, una molecola fotosensibile, responsabile nella visione dei vertebrati.
La vitamina D3 è presente in molti alimenti ma è prevalentemente assunta attraverso il latte intero. Essa aiuta a regolare il metabolismo del calcio e del fosforo. La sua carenza causa rachitismo e favorisce lo sviluppo della osteoporosi.
La vitamina E svolge una azione prevalentemente antiossidante e quindi protegge dall’ossidazione le catene laterali insature degli acidi grassi. Una carenza di questa vitamina causa svariati problemi neurologici.
La vitamina E svolge una azione prevalentemente antiossidante e quindi protegge dall’ossidazione le catene laterali insature degli acidi grassi. Una carenza di questa vitamina causa svariati problemi neurologici.
Infine la vitamina K regola la sintesi di diversi fattori proteici necessari per la coagulazione del sangue. Una sua carenza determina emorragie eccessive, dovute a una scarsa tendenza del sangue a coagularsi.

Terpeni
La distillazione in corrente di vapore di numerosi vegetali fornisce una miscela di liquidi profumati, che prendono il nome di oli essenziali. Essi consistono in larga misura in molecole piccole dette terpeni, di solito formate solo da carbonio ed idrogeno, ma spesso contenenti anche ossigeno.
Molte di essi sono quindi idrocarburi, possono avere diversi doppi legami carbonio-carbonio e presentarsi in strutture contenenti uno o più cicli. Quando è presente l’ossigeno ci possiamo trovare di fronte ad alcoli, eteri, aldeidi e chetoni o acidi carbossilici.
La loro classificazione dunque non è per classi chimiche, ma è basata sul numero complessivo di atomi di carbonio contenuti nella loro struttura. In tutti i terpeni si trova una formale correlazione strutturale con una unità di 5 atomi di carbonio, chiamata isoprene (2-metil-1,3-butadiene).
Le varie strutture sono multiple di questa unità base: ad esempio:
Molte di essi sono quindi idrocarburi, possono avere diversi doppi legami carbonio-carbonio e presentarsi in strutture contenenti uno o più cicli. Quando è presente l’ossigeno ci possiamo trovare di fronte ad alcoli, eteri, aldeidi e chetoni o acidi carbossilici.
La loro classificazione dunque non è per classi chimiche, ma è basata sul numero complessivo di atomi di carbonio contenuti nella loro struttura. In tutti i terpeni si trova una formale correlazione strutturale con una unità di 5 atomi di carbonio, chiamata isoprene (2-metil-1,3-butadiene).
Le varie strutture sono multiple di questa unità base: ad esempio:

"Wine Lactone"
Un interessante esempio che lega la stereochimica nella chimica dei terpeni alla enologia è riportato da Guth, H. in J. Agric. Food Chem. (1997), volume 45, pg. 3022 che è descritto anche in Tetrahedron: Asymmetry (2003) volume 14, pg. 1–42.
In questo lavoro sono state valutate le proprietà odorose di numerosi vini bianchi, ed è stato mostrato che è presente un aroma naturale molto potente, un lattone biciclico. A questa molecola, presente in tracce nel vino, sono state attribuite note dolciastre e di cocco, è stata chiamata appunto “wine lactone”.

Questo lattone deriva dal limonene e avendo 3 carboni chirali sono possibili 8 stereoisomeri. Per poter stabilire a quale stereoisomero corrisponde quello presente nei vini bianchi, i chimici hanno preparato in laboratorio tutte le molecole.
4 stereoisomeri sono stati preparati dal R-(+)-limonene (dalle arance) e gli altri 4 partendo dal S-(-)-limonene (dal limone). Disponendo di tutti gli stereoisomeri, è stato così possibile determinare anche le soglie di percezione di ognuno di essi.
Il lattone 1 ha mostrato una soglia di percezione al di sotto di 0.00001 ng /litro, mentre lo stereoisomero 4, ma anche 8 (che è l’enantiomero di 1), sono risultati molto al di sopra di 1000 ng/litro. Gli stereoisomeri più potenti, con le soglie di percezione più basse, sono risultati i lattoni 1, 2 e 5.
Tutti e tre stereoisomeri hanno configurazione S al carbonio che porta il gruppo metile. Il “lattone del vino” naturale è stato trovato identico allo stereoisomero 1.
4 stereoisomeri sono stati preparati dal R-(+)-limonene (dalle arance) e gli altri 4 partendo dal S-(-)-limonene (dal limone). Disponendo di tutti gli stereoisomeri, è stato così possibile determinare anche le soglie di percezione di ognuno di essi.
Il lattone 1 ha mostrato una soglia di percezione al di sotto di 0.00001 ng /litro, mentre lo stereoisomero 4, ma anche 8 (che è l’enantiomero di 1), sono risultati molto al di sopra di 1000 ng/litro. Gli stereoisomeri più potenti, con le soglie di percezione più basse, sono risultati i lattoni 1, 2 e 5.
Tutti e tre stereoisomeri hanno configurazione S al carbonio che porta il gruppo metile. Il “lattone del vino” naturale è stato trovato identico allo stereoisomero 1.

vedi anche http://www.leffingwell.com/chirality/winelactone.htm
Steroidi
Gli steroidi costituiscono una vasta classe di molecole, che giocano un ruolo biologico essenziale, ed hanno in comune una struttura tetraciclica.
Essi si trovano in tutti gli organismi, sia animali sia vegetali, ma quelli più importanti sono di origine animale. Lo steroide più diffuso è un alcol cristallino, il colesterolo, C27H46O.
Nella sua struttura sono presenti ben 8 atomi di carbonio asimmetrici, e dunque sono possibili complessivamente 256 stereoisomeri. Ma solo uno è presente in natura.
La trasformazione biochimica del colesterolo conduce a numerose altre molecole di tipo steroideo, essenziali per il metabolismo e la riproduzione nei mammiferi, come gli acidi biliari, la vitamina D3, gli ormoni corticali come il cortisone, che ha una potente azione antiinfiammatoria, e gli ormoni sessuali.
Di seguito sono anche mostrati alcuni ormoni sintetici utilizzati nella prevenzione di gravidanze indesiderate.
Nella sua struttura sono presenti ben 8 atomi di carbonio asimmetrici, e dunque sono possibili complessivamente 256 stereoisomeri. Ma solo uno è presente in natura.
La trasformazione biochimica del colesterolo conduce a numerose altre molecole di tipo steroideo, essenziali per il metabolismo e la riproduzione nei mammiferi, come gli acidi biliari, la vitamina D3, gli ormoni corticali come il cortisone, che ha una potente azione antiinfiammatoria, e gli ormoni sessuali.
Di seguito sono anche mostrati alcuni ormoni sintetici utilizzati nella prevenzione di gravidanze indesiderate.

8 mag 2009
Nucleotidi ed acidi nucleici
Nucleotidi ed acidi nucleici
Pirimidine e Purine
Al fine di comprendere la struttura e le proprietà del DNA e del RNA, abbiamo bisogno di guardare in dettaglio ai loro componenti strutturali.
Cominciamo da alcuni composti eterociclici aromatici, chiamati pirimidine e purine. Il nome di pirimidine e purine è attribuito alle molecole derivate da due archetipi di composti eterociclici aromatici a 6 termini, particolarmente ricchi di atomi di azoto, la pirimidina e la purina.
Cominciamo da alcuni composti eterociclici aromatici, chiamati pirimidine e purine. Il nome di pirimidine e purine è attribuito alle molecole derivate da due archetipi di composti eterociclici aromatici a 6 termini, particolarmente ricchi di atomi di azoto, la pirimidina e la purina.

Le pirimidine che si trovano nel DNA sono citosina e timina: mentre nell’RNA ritroviamo citosina e uracile:

L’adenina e la guanina sono le purine contenute sia nel DNA sia nel RNA:

Una prima sommaria ispezione delle strutture di queste molecole potrebbe far concludere che le pirimidine e le purine che contengono un gruppo carbonilico (citosina, timina, uracile e guanina) non siano sostanze aromatiche, perché non raggiungendo i 4n+2 elettroni π nel ciclo, non soddisfano la regola di Huckel.
In realtà, se analizziamo in profondità una di queste strutture, per esempio quella della citosina, possiamo osservare che la sua struttura può essere meglio descrivibile come una specie presente in equilibri cheto-enolici (tautomeria), originati da rapidi scambi protonici tra gli atomi di azoto (1 e 2) e tra l’azoto e l’ossigeno (3). L’ultimo tautomero (3) presenta un gruppo ossidrilico legato direttamente all’anello aromatico, proprio come il fenolo.
In realtà, se analizziamo in profondità una di queste strutture, per esempio quella della citosina, possiamo osservare che la sua struttura può essere meglio descrivibile come una specie presente in equilibri cheto-enolici (tautomeria), originati da rapidi scambi protonici tra gli atomi di azoto (1 e 2) e tra l’azoto e l’ossigeno (3). L’ultimo tautomero (3) presenta un gruppo ossidrilico legato direttamente all’anello aromatico, proprio come il fenolo.
Per analogia con la struttura dei fenoli quindi, potremmo attenderci che l’isomero (tautomero) 3, con il gruppo OH sull’anello aromatico, sia il più stabile. Questo in realtà non è vero, perché gli equilibri tautomerici favoriscono la forma carbonilica essendo in questo caso è più stabile della forma enolica.
La forma enolica (un doppio legame ed un ossidrile presenti sullo stesso carbonio ibridato sp2) infatti presenta un ossidrile, con caratteristiche debolmente acide, insieme ad atomi di azoto con caratteristiche debolmente basiche.
La contemporanea presenza di queste due funzionalità non favorisce la stabilità della struttura, che è dunque sfavorita da semplici considerazioni acido-base. Inoltre va osservato che le forme carboniliche conservano una struttura aromatica, a causa della risonanza del legame ammidico (lezione del 24/03). Questa prevalenza della forma chetonica e della loro aromaticità ha, come vedremo, conseguenze enormi sulla stabilità e la capacità di replicazione degli acidi nucleici.
Infatti un gruppo carbonilico si comporta sempre come accettore di legami ad idrogeno, mentre un gruppo ossidrilico è notoriamente un donatore nei legami ad idrogeno.
La contemporanea presenza di queste due funzionalità non favorisce la stabilità della struttura, che è dunque sfavorita da semplici considerazioni acido-base. Inoltre va osservato che le forme carboniliche conservano una struttura aromatica, a causa della risonanza del legame ammidico (lezione del 24/03). Questa prevalenza della forma chetonica e della loro aromaticità ha, come vedremo, conseguenze enormi sulla stabilità e la capacità di replicazione degli acidi nucleici.
Infatti un gruppo carbonilico si comporta sempre come accettore di legami ad idrogeno, mentre un gruppo ossidrilico è notoriamente un donatore nei legami ad idrogeno.

Le purine e le pirimidine sono molecole molto diffuse in natura e tra loro vanno comprese, ad esempio, la caffeina e la teobromina, (ritrovate nel caffè e nel tè rispettivamente). Sono chiaramente visibili le forti analogie strutturali con le basi puriniche trovate negli acidi nucleici:

Nucleosidi
Gli N-glicosidi si formano quando un monosaccaride reagisce con una ammina, in condizione debolmente acide. Analogamente agli O-glicosidi, anche in questo caso si possono ottenere gli anomeri alfa e beta.
In particolare gli N-glicosidi, ottenuti con le ammine eterocicliche aromatiche di tipo puriniche e pirimidinico, da due pentosi - il D-ribosio e il 2-deossi-D-ribosio - sono particolarmente importanti, essendo le unità costitutive rispettivamente dell’RNA e del DNA.
Questi particolari N-glicosidi sono definiti nucleosidi, ma questa definizione va estesa in generale a tutti gli O,N-acetali contenenti purine o pirimidine normali o presentanti modificazioni strutturali, indipendentemente dalla natura del monosaccaride.
Le parti puriniche e pirimidiniche di un nucleoside sono riferite come basi puriniche o pirimidiniche.
In particolare gli N-glicosidi, ottenuti con le ammine eterocicliche aromatiche di tipo puriniche e pirimidinico, da due pentosi - il D-ribosio e il 2-deossi-D-ribosio - sono particolarmente importanti, essendo le unità costitutive rispettivamente dell’RNA e del DNA.
Questi particolari N-glicosidi sono definiti nucleosidi, ma questa definizione va estesa in generale a tutti gli O,N-acetali contenenti purine o pirimidine normali o presentanti modificazioni strutturali, indipendentemente dalla natura del monosaccaride.
Le parti puriniche e pirimidiniche di un nucleoside sono riferite come basi puriniche o pirimidiniche.
Uridina and Adenosina
Ad esempio l’uridina è un nucleoside formato da uracile e D-ribofuranosio, mentre l’adenosina è un nucleoside formato da adenina e D-ribofuranosio.
Da notare che è sempre un atomo di azoto presente nel ciclo dell’eterociclo che è legato al carbonio anomerico. Tutti i nucleosidi trovati negli acidi nucleici hanno inoltre una stereochimica beta, con le basi puriniche e pirimidiniche che sono in posizione cis rispetto al gruppo -CH2-OH dell’anello furanosidico.
Ai nucleosidi viene assegnata una numerazione ad entrambi gli anelli e si aggiunge l’indice (‘) al monosaccaride al fine di descrivere separatamente le funzionalità presenti.

Nucleotidi
I Nucleotidi sono esteri fosforici dei nucleosidi.
Ad esempio la deossi-adenosina 5'-monofosfato (dAMP) è un deossi-ribonucleotide che presenta un legame estereo tra l’ossidrile in posizione 5’ del 2-deossi-D-ribosio e l’acido fosforico. L’uridina 5’-monofosfato è invece un ribonucleotide (UMP).

Esistono quindi i 4 deossi-ribonucleotidi della adenina (A), guanina (G), timina (T), e citosina (C) e i 4 ribonucleotidi della adenina (A), guanina (G), uracile (U), e citosina (C).
Altri importanti 5’-ribonucleotidi dell’adenosina (non contenuti negli acidi nucleici, ma fondamentali per la loro sintesi) sono l’adenosina 5’-difosfato (ADP) e l’adenosina 5’-trifosfato (ATP). La molecola di ATP è la principale fonte di energia per ogni forma di vita sulla terra. Numerose e fondamentali trasformazioni biologiche coinvolgono l’ATP, come ad esempio la fosforilazione, in cui l’ATP trasferisce uno dei suoi gruppi fosfato al gruppo OH di un’altra molecola, in processi catalizzati da enzimi chiamati chinasi.
Altri importanti 5’-ribonucleotidi dell’adenosina (non contenuti negli acidi nucleici, ma fondamentali per la loro sintesi) sono l’adenosina 5’-difosfato (ADP) e l’adenosina 5’-trifosfato (ATP). La molecola di ATP è la principale fonte di energia per ogni forma di vita sulla terra. Numerose e fondamentali trasformazioni biologiche coinvolgono l’ATP, come ad esempio la fosforilazione, in cui l’ATP trasferisce uno dei suoi gruppi fosfato al gruppo OH di un’altra molecola, in processi catalizzati da enzimi chiamati chinasi.

Le conversioni di AMP in ADP e poi in ATP sono processi endotermici e l’energia di ogni processo viene ottenuta dal metabolismo dei carboidrati (glicolisi).
I processi inversi, cioè di idrolisi dei tri-fosfati e di-fosfati a monofosfati, sono esotermici e costituiscono, come detto, la fonte primaria dell’energia biologica.
Esiste anche un’altra molecola di fondamentale importanza associata all’AMP che è l’adenosina 3’-5’ monofosfato ciclico (cAMP). Essa, insieme alla guanina 3’-5’ monofosfato (cGMP), costituisce un importante regolatore di molti processi biologici:
I processi inversi, cioè di idrolisi dei tri-fosfati e di-fosfati a monofosfati, sono esotermici e costituiscono, come detto, la fonte primaria dell’energia biologica.
Esiste anche un’altra molecola di fondamentale importanza associata all’AMP che è l’adenosina 3’-5’ monofosfato ciclico (cAMP). Essa, insieme alla guanina 3’-5’ monofosfato (cGMP), costituisce un importante regolatore di molti processi biologici:

Dinucleotidi
Confrontiamo, le strutture tridimensionali di un ribonucleotide e di un deossi-ribonucleotide, per esempio AU (RNA) e AT (DNA):
Nel ribonucleotide AU esiste un ossidrile libero in posizione 2', e vi può essere la possibilità di formare legami ad idrogeno (come donor).
Questa possibilità può influenzare la capacità e l'intensità della base successiva o legata alla posizione anomerica dello stesso ciclo di formare legami ad idrogeno, rendendo quindi più complicata la formazione della doppia elica.
Acidi Nucleici
Confrontiamo, le strutture tridimensionali di un ribonucleotide e di un deossi-ribonucleotide, per esempio AU (RNA) e AT (DNA):
Nel ribonucleotide AU esiste un ossidrile libero in posizione 2', e vi può essere la possibilità di formare legami ad idrogeno (come donor).
Questa possibilità può influenzare la capacità e l'intensità della base successiva o legata alla posizione anomerica dello stesso ciclo di formare legami ad idrogeno, rendendo quindi più complicata la formazione della doppia elica.
Gli acidi nucleici sono biopolimeri i cui monomeri sono i nucleotidi (polinucleotidi). In essi, un gruppo fosfato fa da ponte legando l’ossigeno in 5' di un nucleotide all’ossigeno in 3’ di un altro nucleotide.
Di seguito un frammento di DNA, -----AGCT------

Struttura e replicazione del DNA: La doppia elica
Composizione del DNA
Molti studi condotti sui DNA provenienti da varie fonti insieme all’analisi della distribuzione di purine e pirimidine in essi contenuti hanno consentito di chiarire la struttura e le strabilianti capacità replicative degli acidi nucleici.
La distribuzione delle basi adenina (A), guanina (G), timina (T), e citosina (C) varia al variare delle fonti. Ma le quantità totali di purine (A + G) e di pirimidine (T + C) risultano essere sempre uguali. Inoltre si trova sempre che la %A è sempre uguale alla %T, e la %G è sempre uguale alla %C.
Ad esempio si trova che la composizione del DNA umano è la seguente:
Adenina (A) = 30,3% Timina (T) = 30.3%
Guanina (G) = 19.5% Citosina (C) = 19.9%
Totale purine = 49.8% Totale pirimidine = 50.2%
Accoppiamento delle Basi
Watson e Crick hanno proposto che l’adenosina (A) e la timina (T) venivano ritrovate in uguale quantità a causa della funzionalità reciproca nella formazione di legami ad idrogeno.

Analogamente, la guanina G e la citosina C sono presenti in eguale quantità a causa della loro complementarietà nella formazione di legami ad idrogeno.

Watson e Crick hanno quindi proposto la struttura a doppio filamento del DNA, nella quale basi puriniche o pirimidiniche di una catena sono accoppiate con legami ad idrogeno in maniera complementare alle basi presenti nell’altra catena.
Quindi i due filamenti antiparalleli di DNA sono accoppiati da legami ad idrogeno tra le basi puriniche e pirimidiniche. Come si può osservare le basi aromatiche, planari, sono confinate perfettamente all’interno della struttura a doppia elica, formando dei legami ad idrogeno che stabilizzano questa architettura molecolare, mentre lo scheletro di carboidrati e i gruppi fosfato sono orientati verso l’esterno della struttura.
Quindi i due filamenti antiparalleli di DNA sono accoppiati da legami ad idrogeno tra le basi puriniche e pirimidiniche. Come si può osservare le basi aromatiche, planari, sono confinate perfettamente all’interno della struttura a doppia elica, formando dei legami ad idrogeno che stabilizzano questa architettura molecolare, mentre lo scheletro di carboidrati e i gruppi fosfato sono orientati verso l’esterno della struttura.

Replicazione del DNA
Con lo “svolgimento” della doppia elica, ogni filamento agisce da stampo per la costruzione di un filamento complementare. Da una molecola di DNA se né ottengono quindi due.
La replicazione è catalizzata dall’enzima DNA polimerasi. Il DNA non ha solo la capacità di auto replicazione ma dirige anche la biosintesi proteica attraverso la formazione di un altro acido nucleico, l’RNA. E’ proprio questo il dogma centrale di tutta la biologia molecolare: Il DNA fa l’RNA e l’RNA fa le proteine. La sintesi proteica è realizzate in due stadi principali: la trascrizione e la traduzione.
In realtà ci sono tre tipi di RNA coinvolti in questa sintesi: l’RNA messeggero (mRNA), l’RNA transfer (tRNA) e l’RNA ribosomiale (rRNA). Nella trascrizione viene formato un filamento di mRNA usando come stampo uno dei due filamenti del DNA. La sequenza nucleotidica del mRNA è complementare alla sequenza nucleotidica del DNA.
La replicazione è catalizzata dall’enzima DNA polimerasi. Il DNA non ha solo la capacità di auto replicazione ma dirige anche la biosintesi proteica attraverso la formazione di un altro acido nucleico, l’RNA. E’ proprio questo il dogma centrale di tutta la biologia molecolare: Il DNA fa l’RNA e l’RNA fa le proteine. La sintesi proteica è realizzate in due stadi principali: la trascrizione e la traduzione.
In realtà ci sono tre tipi di RNA coinvolti in questa sintesi: l’RNA messeggero (mRNA), l’RNA transfer (tRNA) e l’RNA ribosomiale (rRNA). Nella trascrizione viene formato un filamento di mRNA usando come stampo uno dei due filamenti del DNA. La sequenza nucleotidica del mRNA è complementare alla sequenza nucleotidica del DNA.
La trascrizione inizia alla posizione finale 5' del DNA ed è catalizzata dall’enzima RNA polimerasi. In questo stadio l’uracile è incorporato al posto della timina. La sequenza nucleotidica del mRNA prodotto può codificare per i differenti amminoacidi trovati nelle proteine.
L’alfabeto che definisce il linguaggio del codice genetico viene quindi tradotto nell’alfabeto che definisce il linguaggio delle proteine. Sono necessari 3 nucleotidi per codificare ogni singolo amminoacido.
Le triplette di nucleotidi vengono così definiti codoni. Le possibili combinazioni delle 4 basi A, U, G, e C che formano le triplette sono complessivamente 64, e cosi si riscontra una ridondanza nel codice genetico. Molti amminoacidi sono codificati da più di una tripletta di basi.
Ci sono poi 20 differenti tRNA, ognuno specifico per ogni amminoacido. Un particolare amminoacido è attaccato al proprio tRNA da un legame estereo formato dal gruppo carbossilico dell’amminoacido e dal gruppo ossidrilico in posizione 3’ tRNA.
L’alfabeto che definisce il linguaggio del codice genetico viene quindi tradotto nell’alfabeto che definisce il linguaggio delle proteine. Sono necessari 3 nucleotidi per codificare ogni singolo amminoacido.
Le triplette di nucleotidi vengono così definiti codoni. Le possibili combinazioni delle 4 basi A, U, G, e C che formano le triplette sono complessivamente 64, e cosi si riscontra una ridondanza nel codice genetico. Molti amminoacidi sono codificati da più di una tripletta di basi.
Ci sono poi 20 differenti tRNA, ognuno specifico per ogni amminoacido. Un particolare amminoacido è attaccato al proprio tRNA da un legame estereo formato dal gruppo carbossilico dell’amminoacido e dal gruppo ossidrilico in posizione 3’ tRNA.
4 mag 2009
Amminoacidi e peptidi
Amminoacidi e peptidi
Il nome di queste sostanze contiene l’informazione che gli amminoacidi sono composti che contengono nella loro struttura un gruppo amminico —NH2 e un gruppo carbossilico —CO2H. In realtà queste funzionalità sono presenti come
—NH3+ e —CO2– rispettivamente.
Essi vengono classificati come alfa, beta, gamma, etc. amminoacidi, in relazione all’atomo di carbonio a cui è legato l’atomo di azoto. Ad esempio:

Finora più di 1000 amminoacidi sono stati trovati in natura, ma solo 20 di essi rivestono una importanza speciale. Questi 20 amminoacidi sono i mattoni con cui sono costruite le proteine. Tutti sono alfa-amminoacidi.
Essi differiscono per il gruppo R che è legato al carbonio alfa. Le proprietà degli amminoacidi variano al variare della struttura di R.

Di seguito sono illustrati i 20 amminoacidi proteinogenici. Quelli segnati in verde sono definiti essenziali e bisogna assumerli con la dieta, perché noi siamo incapaci di sintetizzarli a partire da altre molecole.
 La Glicina è l’amminoacido più semplice (R = H) ed è achirale. Tutti gli altri
La Glicina è l’amminoacido più semplice (R = H) ed è achirale. Tutti gli altri
alfa-amminoacidi che sono presenti nelle proteine hanno almeno uno stereocentro.
In natura si ritrovano amminoacidi appartenenti ad entrambe le serie steriche, ma quelli presenti nelle proteine appartengono tutti alla serie sterica L:
In natura si ritrovano amminoacidi appartenenti ad entrambe le serie steriche, ma quelli presenti nelle proteine appartengono tutti alla serie sterica L:

Passando alla descrizione della stereochimica assoluta, generalmente il carbossile ha una priorità maggiore di R, e dunque la serie sterica L corrisponde ad una configurazione assoluta S.
Tuttavia nel caso della cisteina il gruppo R (-CH2SH) ha priorità rispetto al carbossile e questo residuo pur appartenendo alla serie sterica L, ha stereochimica assoluta R.
Tuttavia nel caso della cisteina il gruppo R (-CH2SH) ha priorità rispetto al carbossile e questo residuo pur appartenendo alla serie sterica L, ha stereochimica assoluta R.

Se analizziamo le proprietà fisiche della glicina si nota che essa ha un alto punto di fusione (233 °C, con decomposizione) ed è insolubile nei comuni solventi organici, ma molto solubile in acqua.
Questi dati, comuni a molti altri alfa-amminoacidi, sono in accordo con una struttura ionica definita zwitterione o ione dipolare:

La struttura degli amminoacidi è effettivamente quella zwitterionica, come si evince anche dalle considerazioni che seguono sulle loro proprietà acido-base.
Per inquadrare nella maniera più semplice le proprietà acido-base degli amminoacidi, cominciamo a considerare il comportamento della glicina in un mezzo fortemente acido, per esempio a pH = 1.
A questo valore di pH, la glicina esiste nella sua forma protonata (un monocatione). Ora ci possiamo chiedere: se aumentiamo il pH qual'è il primo protone che verrà rimosso? Le possibilità sono 2, il protone legato all’atomo di ossigeno del carbossile oppure quello legato all’atomo di azoto positivo.
Possiamo operare una scelta in base ai valori stimati dei rispettivi pKa, e cioè dal pKa1 del gruppo carbossilico e dal pKa2 dello ione alchilammonio.
Il protone più acido è quello che appartiene al gruppo carbossilico.
Esso è il primo ad essere rimosso. Di conseguenza, la forma neutra più stabile della glicina, è proprio quella zwitterionica.

In realtà il pKa1 della glicina è 2.34. Quindi la glicina è circa 100 volte più acido dell’acido acetico. Questo valore riflette la presenza in posizione alfa di un atomo di azoto caricato positivamente, che agisce da gruppo elettron-attrattore, stabilizzando lo ione carbossilato, carico negativamente.
Un protone legato all’atomo di azoto nella forma zwitterionica può essere rimosso se il pH aumenta ulteriormente. Il pKa2 che governa la rimozione di questo protone è 9.60.
Questo valore è all’incirca lo stesso di quello di uno ione ammonio NH4+ (pKa = 9.30). La funzione amminica di un alfa-amminoacido è leggermene più basica dell’ammoniaca e di una ammina primaria.
Il pH al quale la concentrazione dello zwitterione è massima è definito punto isoelettrico (pI). Il suo valore numerico è la media dei valori di pKa1 e pKa2. Il pI della glicina è 5.97.

Gli amminoacidi hanno valori di pKa1 e pKa2 differenti, perché questi dipendono dalla natura del gruppo R. Le proprietà acido-base degli amminoacidi determinano anche le proprietà delle proteine che essi formano.
Le differenze nei valori del punto isoelettrico hanno una notevole utilità dal punto di vista analitico. Esse consentono di definire delle metodiche adeguate alla loro separazione ed identificazione.
Nel caso di amminoacidi che recano sulla catena laterale altre funzionalità acido-base, il punto isoelettrico può assumere valori molto bassi o molto alti. Consideriamo i casi dell’acido aspartico e della lisina:

Al punto isoelettrico un amminoacido non ha una carica netta e quando è posto in un campo elettrico non si ha migrazione di materia ne al catodo ne all’anodo. Per l’acido aspartico il pH al quale corrisponde la massima concentrazione dello zwitterione deve essere quel valore di pH che permette l’esistenza della funzione alfa-carbossilica in forma dissociata (governata dal pKa1) e la contemporanea presenza della funzione beta-carbossilica in forma indissociata (governata dal pKa2).
Di conseguenza questo valore è la media dei valori di pKa1 e pKa2 e cade quindi in un pH notevolmente acido. Analoghe considerazioni possono essere fatte per l’amminoacido lisina. Al punto isoelettrico questo amminoacido deve presentare la funzione carbossilica dissociata e solo la funzione e-amminica protonata. Il suo pI è quindi la media dei valori di pKa2 e pKa3.
Peptidi: I peptidi sono composti nei quali un legame ammidico lega il gruppo amminico di un amminoacido e il gruppo carbossilico di un altro. Un legame ammidico di questo tipo è spesso riferito come un legame peptidico.
I peptidi sono classificati in accordo al numero di amminoacidi legati insieme.
Così abbiamo dipeptidi, tripeptidi, tetrapeptidi, etc. Quando il numero di amminoacidi supera le 50 unità, si parla esplicitamente di proteine.
Consideriamo un caso molto semplice, la formazione di un dipeptide tra glicina e alanina:

In realtà, un legame ammidico si può formare impegnando il carbossile della glicina e la funzione amminica della alanina, ma anche viceversa, cioè utilizzando il gruppo carbossilico della alanina e la funzione amminica della glicina.
Questa doppia possibilità conduce alla formazione di due dipeptidi diversi, che sono fra di loro isomeri strutturali:

Questi due dipeptidi hanno proprietà chimico-fisiche diverse, ma in generale isomeri strutturali di questo tipo possono avere anche proprietà biologiche decisamente diverse.
A questo proposito un aspetto particolarmente interessante riguarda in numero di strutture peptidiche possibili, a partire da un numero finito di amminoacidi. Se indichiamo con L la lunghezza del peptide (di-, tri-, tetra-, etc.) e con m il numero degli amminoacidi coinvolti, abbiamo la seguente relazione generale, che mostra il numero complessivo n di possibili peptidi:
n = (m)eL.
Nel caso che abbiamo appena visto, volendo formare dipeptidi utilizzando solo glicina e alanina, sono possibili ben 4 dipeptidi (2e2), perché sono possibili anche i dipeptidi Gly-Gly ed Ala-Ala, con i singoli amminoacidi che condensano con se stessi.
Per esempio sono possibili ben 32 pentapeptidi costruiti utilizzando solo Gly ed Ala: n = 2e5 = 32

Strutture secondarie di Peptidi e di Proteine
Essendo le proteine delle macromolecole costituite da centinaia di amminoacidi, la loro struttura può essere esaminata a vari livelli:
• Il primo luogo abbiamo la struttura primaria di una proteina, che riflette semplicemente la sequenza degli amminoacidi da cui è composta e vanno aggiunti anche i ponti disolfuro.
• La struttura secondaria definisce le relazione conformazionali tra residui amminoacidici vicini. Le due principali strutture secondarie individuate sono la alfa-elica e quella cosiddetta a foglietti beta-ripiegati. Queste due strutture sono entrambe caratterizzate dalla geometria planare dei legami peptidici e da una disposizione di tipo anti delle catene laterali ed infine da legami ad idrogeno tra gruppo N-H e C=O.
• La struttura terziaria è riferita alla forma complessiva che una catena polipeptidica assume e può essere classificata secondo due criteri generali: le strutture fibrose (capelli tendini, lana) hanno una forma allungata; oppure strutture globulari, approssimativamente sferiche. Molti enzimi sono proteine globulari come ad esempio la carbossipeptidasi.
• Infine in alcune proteine è possibile osservare delle strutture quaternarie. Infatti alcune proteine sono un assemblaggio di due o più catene. I modi in cui queste catene sono organizzate tra loro vengono chiamati strutture quaternarie. Un esempio è costituita dalla emoglobina, che consiste di 4 sub-unità. Ci sono due identiche catene alfa e due identiche catene beta. Ogni sub-unità contiene un gruppo eme.
Iscriviti a:
Commenti (Atom)